
Figura 1 – Formação típica de savana com plantas de porte arbóreo, arbustivas e herbáceas típicas do Bioma Cerrado. (Foto: Marina Lapenta)
O Cerrado é o segundo maior bioma brasileiro ocupando uma área de 204,7 milhões de hectares na porção central do Brasil. Este bioma estende-se diagonalmente na direção nordeste-sudeste desde o Pantanal Matogrossense até a faixa litorânea maranhense (IBGE, 2004). Sendo assim, engloba parte dos estados da Bahia, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Paraná, Piauí, São Paulo, Tocantins e o Distrito Federal e interpõe-se entre os biomas Amazônia, Mata Atlântica, Pantanal e Caatinga (SANO et al., 2008; IBGE, 2004).
A fitofisionomia predominante no Cerrado é a savana, ocorrendo formações florestais, arbustivas e herbáceas (figura 1). Em sua maioria a vegetação do Cerrado apresenta uma morfologia bastante típica com árvores de pequeno porte, retorcidas, de casca grossa e com poucas folhas. Estas plantas estão muito bem adaptadas para o clima rigoroso das regiões por onde o Cerrado se estende.
Entre as espécies arbóreas mais populares encontradas no Cerrado podemos citar a árvore símbolo do Brasil, o Ipê amarelo (Tabebuia chrysotricha – Bignoniaceae), a peroba (Aspidosperma sp – Apocynaceae), o jatobá (Hymenaea stigonocarpa – Fabaceae), a embaúba (Cecropia pachystachya – Cecropiaceae) e o jenipapo (Genipa americana – Rubiaceae) entre muitas outras espécies. A savana arborizada é a que mais caracteriza a fitofisionomia do Cerrado, ocupando a maior parte deste bioma e abrigando a maioria de suas espécies endêmicas. Algumas espécies arbustivas são encontradas facilmente no Cerrado como as ananás (da família Annonaceae), a canela de ema (Vellozia squamata) o balsaminho (Davilla rugosa), erva de bicho (Polygonum sp), a maria preta (Miconia albicans), as sempre vivas (Paepalanthus sp) e o capim dourado (Syngonanthus nitens) mas, estas duas últimas, devido ao extrativismo desordenado para sua utilização no artesanato tem sofrido um forte impacto ambiental (RONDON NETO et al., 2010).
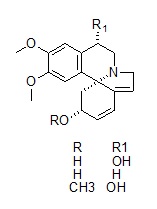
Figura 2 – Alcaloides eritrínicos com atividade ansiolítica isolados de Erythrina mulungu do Cerrado.
O número de plantas vasculares existentes no Cerrado é superior àquele encontrado na maioria das regiões do mundo e estima-se que possua cerca de 10 mil espécies (RONDON NETO et al., 2010). Cerca de 40% da flora é endêmica o que faz do Cerrado a mais diversificada savana tropical do mundo e é considerado um dos hotspots em biodiversidade. A flora do Cerrado pode ser utilizada de forma sustentável para uso direto e como fonte de renda para a população local. Muitas espécies se destacam como alimentícias, medicinais e são muito utilizadas como artesanato. No entanto, muito ainda a que se explorar para conhecer o potencial da flora do Cerrado visando à valorização desses recursos e combatendo o extrativismo predatório (RONDON NETO et al., 2010). Cerca da metade da região de Cerrado já foi desmatada para diferentes usos da terra, sendo que 40% da sua área total são ocupados por áreas de pastagens e culturas agrícolas (SANO et al., 2008).
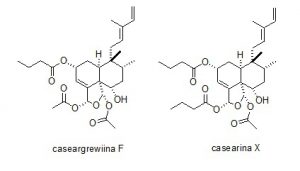
Figura 3 – Diterpenos clerodânicos bioativos, caseargrewiina F e casearina X isolados de C. sylvetris
Em termos de diversidade fitoquímica as plantas do Cerrado oferecem uma fonte riquíssima de moléculas das diferentes classes de metabólitos secundários, no entanto, até hoje ainda tão pouco explorados. De espécies da família Velloziaceae, por exemplo, foram isoladas diferentes subclasses de diterpenos, especialmente os isopimaranos, clerodanos, cleistantanos e totaranos (SILVA et al., 2010). As espécies de Erythrina são comuns no Cerrado, sendo que a população faz muito uso de Erythrina mulungu (Fabaceae) como calmante. Partindo deste conhecimento tradicional Flausino Jr e colaboradores (2007) realizaram estudos fitoquímico e farmacológico e identificaram os alcaloides eritrínicos mostrados na figura 2, como os responsáveis pelo efeito ansiolítico da planta o que os torna candidatos promissores para o desenvolvimento de fármacos ansiolíticos.
Casearia sylvestris (Salicaceae) é uma árvore que cresce por todo o território brasileiro, especialmente no Cerrado (FERREIRA et al. 2010). Ela é utilizada popularmente para o tratamento de picadas de cobras, ferimentos, antipirético, antisséptico e anti-ulcerogenico. O extrato de C. sylvestris é ainda vendido em capsulas. Estudos com esta espécie confirmaram suas atividades anti-ulcerogenica (SERTIÈ et al. 2000), anti-inflamatória, antimicrobiana, a citotóxica (ITOKAWA et al. 1990; MORITA et al. 1991). O estudo fitoquímico de espécies de Casearia levou à identificação e isolamento de diterpenos clerodânicos conhecidos como casearinas, casearvestrinas, casearupestrinas, etc. Diterpenos em geral possuem características estruturais complexas e propriedades farmacológicas variadas. De C. sylvestris foram isolados os diterpenos caseargrewiina F (Figura 3), que em baixas concentrações tem efeito protetor do DNA e em baixas concentrações tem efeito contrário sendo mutagênico e genotóxico (OLIVEIRA et al. 2009); e casearina X (Figura 3) que exibe forte citotoxicidade em linhagens de célula citotóxicas (SANTOS et al. 2010).
REFERÊNCIAS
Ferreira, P. M. P.; Santos, A. G.; Tininis, A. G.; Costa, P.M; Cavalheiro, A.J.; Bolzani, V.S.; Moraes, M.O.; Costa-Lotufo, L.V.; Montenegro, R.C.; Pessoa, C. Casearin X exhibits cytotoxic effects in leukemia cells triggered by apoptosis Chemico-Biological Interactions. 188, p. 497(2010).
Flausino Jr, O.; Santos, L. A.; Verli, H.; Pereira, A. M.; Bolzani, V. S.; Nunes-de-Souza, R. L. J. Nat. Prod. 2007, 70, 48–53.
IBGE, 2004. Disponível em: http://mapas.ibge.gov.br/biomas2/viewer.htm Acesso em: 08/12/2012.
Itokawa, H.; Totsuka, N.; Morita, H.; Takeya, K.; Iitaka, Y.; Schenkel, E. P. Motidome, M. Chem. Pharm. Bull. 38, p. 3384 (1990).
Morita, H.; Nakayama, M.; Kojima, H.; Takeya, K.; Itokawa, H.; Schenkel, E. P.; Motidome, M.; Chemical & Pharmaceutical Bulletin. 39, p. 693 (1991).
Oliveira, A.M.; Santos, A.G.; Santos, R.A.; Csipak, A.R.; Olivato, C.; Silva, I.C.; Freitas, M.B.; Bassi, C.L.; Cavalheiro, A.J.; Bolzani, V.S.; Silva, D.H.S.; Sakamoto-Hojo, E.T.; Takahashi, C.S.; Soares, C.P. Mutagenesis. 24, p. 501 (2009).
Rondon Neto, R.M.; Santos, J.S.; Silva, M.A.; Koppe, V.C. Rev. Biol. Ciênc. Terra. 10, p. 113 (2010).
Sano, E.E.; Rosa, R.; Brito, J.L.S.; Ferreira, L.G. Pesq. Agropec. Bras. 43, p. 153 (2008).
Santos, A.G.; Ferreira, P.M.P.; Vieira Jr, G.M.; Perez, C.C.; Tininis, A.G.; Silva, G.H.; Bolzani, V.S.; Costa-Lotufo, L.V.; Pessoa, C.O.; Cavalheiro, A.J. Chemistry & Biodiversity., 7, p. 205 (2010).
Sertié, J.A.A.; Carvalho, J.C.T.; Panizza, S. Pharm. Biol. 38, p. 112 (2000).
Silva, D.H.S.; Castro-Gamboa, I.; Bolzani, V.S. In: Comprehensive Natural Products II Chemistry and Biology. Oxford. Verpoorte, R. (2010).

